作者| 市界可楊
編輯| 朗明
3月25日,據中國證券報報導,對於瑞德西韋的生產,吉利德公司在中國大陸可能採用委託生產,而不會採用授權專利給國內同行的方式。
此外,據美國食品藥品管理局官網顯示,FDA已授予了瑞德西韋孤兒藥資格,適應症為新冠肺炎。不過目前,該藥的狀態仍為“Not FDA approved for orphan indication”,即還未獲得“孤兒藥”用途的上市批准。
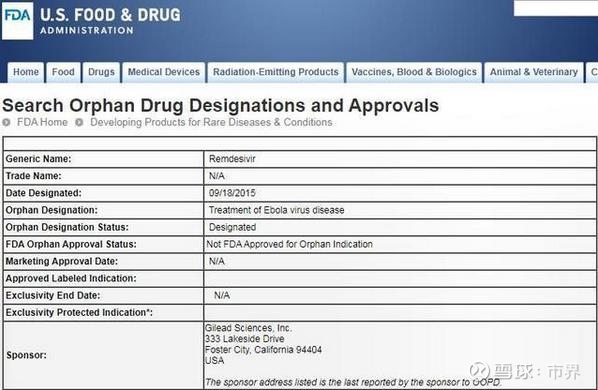
所謂的“孤兒藥”又稱罕見藥,是用於預防、治療和診斷罕見病的藥,由於罕見病患病人群少、市場需求少、研發成本高,少有製藥企業關注此類治療藥物的研發。根據美國FDA《孤兒藥法案》,獲得孤兒藥資格認定的新藥,就有機會獲得7年的市場獨占權,7年內任何藥廠不得仿製該藥物用於在獲批適應症領域進行治療,也就是說,若瑞德西韋作為適應症為新冠肺炎的孤兒藥獲批,則7年內其他藥廠不得仿製該藥用於治療新冠肺炎。
此外,獲得孤兒藥認定的新藥還能享受稅費優惠、減免處方藥使用者費用、研發資助和方案協助、快速審批通道等一系列配套措施。此番瑞德西韋拿下孤兒藥認定或將加快其上市速度。
據悉,瑞德西韋是由美國藥企吉利德公司2013年開發,用於對抗埃博拉病毒。在此次對抗新冠肺炎中投入治療。不過值得注意的是,FDA數據庫顯示,2015年9月,瑞德西韋就拿到了埃博拉病毒適應症的孤兒藥資格,不過這一適應症至今沒有獲批。
而在新冠肺炎的治療方面,瑞德西韋的三期臨床試驗還未揭盲,2月時該藥宣布進入臨床試驗時,預計揭盲時間為4月底。在FDA的孤兒藥認定流程中,新藥一般採用先認定,後審批的方式,也就是說,雖然目前瑞德西韋已被認定為新冠肺炎適應症的孤兒藥資格,但最終能否獲批,首先取決於該藥臨床三期後的揭盲結果。
此外,目前瑞德西韋正在武漢開展三期臨床試驗,所涉及適應症為新冠肺炎。若三期臨床試驗揭盲結果顯示瑞德西韋對新冠肺炎安全有效,瑞德西韋將考慮在中國採用委託生產的方式,而非授權專利給國內同行。委託生產即提供原料藥及生產工藝給合作夥伴,由其合作夥伴在境內加工生產。
關於委託生產與授權專利的區別,中律聯企業合規研究院、北京中聞律師事務所顧問律師劉彬告訴市界,相較於授權專利,委託生產的方式下,被委託方只涉及藥品的生產工作,雖然被委託生產往往也會涉及專利授權,但僅限於生產過程,生產方不能將生產出的藥品自主銷售。
同時,在委託生產的模式中,產品最終的銷售宣傳、質量把控均在於專利權人,而若是授權專利的方式則被授權方可涉及生產以及生產以外的環節,包括銷售等(具體應以雙方合同而定),同時,質量的把控也由被授權方掌控 。
劉彬認為,吉利德選擇委託生產一方面可能是出於保護專利技術;另一方面也出於對藥品質量的保障,同時,他認為委託生產的方式能夠提升藥品的利潤空間。他舉例,這樣的生產模式類似於一些國際品牌服裝,在國內工廠進行生產後運往國外,最終又成為進口產品的進入國內市場。
此外,他還表示,授權專利的方式下,被授權方在生產後可以在包裝上使用自己的商標,但委託生產則只能使用吉利德的商標,生產方無權打上商標。
目前吉利德方面尚未公佈在中國的委託生產合作方,不過仍有一些上市公司因正在研製仿製藥或與吉利德曾有合作而受到關注。
二月中旬,博瑞醫藥以及海南海藥均發佈公告稱完成對瑞德西韋原料藥及製劑的研發,同時物產中大也在互動平台表示其控股子公司已啟動瑞德西韋藥品研發的相關項目。不過這三家公司均因在此事上的違規披露問題受到證監部門關注函。
此外,延安必康董秘曾在互動平台回复投資者稱,正在與吉利德保持聯繫探討合作的可能性;永太科技曾表示,無論是為吉利德還是為國內藥廠在專利許可下的生產,均有能力快速提供瑞德西韋中間體產品,同時永太科技董秘還表示收受到吉利德業務詢盤。
作者:市界
https://xueqiu.com/8430907036/145135764
沒有留言:
張貼留言